Dasar Titrasi Asam Basa
Selasa, 15 Januari 20131comments
Pengertian Titrasi Asam Basa
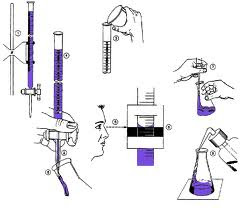
Titrasi merupakan salah satu prosedur dalam ilmu kimia yang digunakan untuk menentukan molaritas dari suatu asam dan basa. Reaksi kimia pada titrasi dikenakan pada "larutan yang sudah diketahui volumenya, namun tidak diketahui konsentrasinya" dan "larutan yang sudah diketahui volume dan konsentrasinya". Tingkat keasaman atau kebasaan dapat ditentukan dengan menggunakan asam atau basa yang ekivalen. Ekivalen asam setara dengan satu mol ion hidronium (H+ atau H3O+). Sedangkan ekivalen basa setara dengan satu mol ion hidroksida (OH-). Jika yang direaksikan adalah asam atau basa poliprotik (banyak ekivalen), maka setiap mol zat tersebut akan melepaskan lebih dari satu H+ atau OH-.Titik Ekivalen
Ketika larutan yang sudah diketahui konsentrasinya direaksikan dengan larutan yang tidak diketahui konsentrasinya, maka akan dicapai titik dimana jumlah asam sama dengan jumlah basa, yang disebut dengan titik ekivalen. Titik ekivalen dari asam kuat dan basa kuat mempunyai pH 7. Untuk asam lemah dan basa lemah, titik ekivalen tidak terjadi pada pH 7. Dan untuk larutan asam basa poliprotik, akan ada beberapa titik ekivalen.Cara Memprediksi Titik Ekivalen
Ada dua cara yang biasa digunakan untuk memprediksi dan menentukan titik ekivalen, yaitu menggunakan pH meter dan indikator asam-basa.Menggunakan pH meter
Metode ini melibatkan grafik sebagai fungsi pH dan volume titran yang dipakai yang disebut dengan kurva titrasi. Contoh kurva titrasi adalah:Menggunakan indikator
Metode ini mengandalkan timbulnya perubahan warna larutan. Indikator asam basa merupakan suatu asam atau basa organik lemah yang mempunyai warna yang berbeda pada keadaan terdisosiasi maupun tidak. Karena digunakan dalam konsentrasi yang rendah, indikator tidak menunjukkan perubahan yang besar pada titik ekivalen. Titik dimana indikator berubah warna merupakan titik akhir titrasi. Untuk titrasi, perbedaan volume antara titik akhir dengan titik ekivalen relatif kecil. Seringkali kesalahan (error) pada perbedaan volume diabaikan. Seharusnya dalam kasus tersebut diberlakukan faktor koreksi. Volume yang ditambahkan untuk mencapai titik akhir dapat dihitung dengan menggunakan rumus sederhana berikut:
VANA = VBNB
dimana V adalah volume, N adalah normalitas, A adalah asam, dan B adalah basa




0 comments:
Post a Comment